引言
结直肠癌(CRC)的靶向治疗革命,始终围绕“如何精准筛选抗表皮生长因子受体(EGFR)治疗获益人群”展开。从最初依靠RAS/BRAF突变“划界”,到如今通过液体活检捕捉亚克隆突变的细微变化,精准检测技术的每一步进阶都在重新定义治疗边界。本文聚焦三篇里程碑式研究,解析结直肠癌精准检测的“三级跳”——核心突变的基础筛选、检测技术的临床落地、亚克隆突变的治疗突破,揭示精准检测如何让更多患者从抗EGFR治疗中获益。
第一级:
核心突变——抗EGFR治疗的“准入红线”
结直肠癌中具有临床意义的致癌突变1
研究概述
结直肠癌(CRC)是全球常见且致命的癌症,其发病率和死亡率居高不下。随着基因组学的发展,基于生物标志物的靶向治疗显著改变了转移性结直肠癌(mCRC)的治疗格局。本文综述了CRC的分子病理学机制及其在精准诊疗中的临床应用,详细探讨了CRC的三种主要致癌途径:染色体不稳定性(CIN)、微卫星不稳定性(MSI)和CpG岛甲基化表型(CIMP),关键致癌突变的临床意义,新兴治疗靶点及分子检测技术的应用,旨在为CRC的精准诊疗提供理论依据。
研究结果
RAS家族:KRAS突变(35-45% CRC)和NRAS突变(3-5% CRC)是抗EGFR治疗耐药的重要预测标志。
BRAF:BRAF V600E突变见于<10%的CRC,提示预后不良。
HER2:HER2扩增见于2-3%的mCRC,在部分CRC患者中与抗EGFR治疗耐药相关,但可能对HER2靶向治疗敏感。
新兴靶点:如RTK融合(ALK、ROS1、NTRK)、FGFR突变/扩增和PIK3CA突变显示出潜在的治疗价值。
NGS:可同时检测多个基因变异,已成为临床常规工具,用于指导靶向治疗(如筛选抗EGFR、抗HER2治疗候选者)。
液体活检:如循环肿瘤DNA(ctDNA)在监测微小残留病灶和预测治疗反应方面表现出良好的应用前景。
研究结论股利网
CRC的分子分型正逐渐成为临床决策的核心依据,为个性化治疗提供了重要支持。目前,MSI状态、RAS和BRAF突变检测已成为转移性CRC的标准检查,特别是RAS/BRAF野生型是抗EGFR治疗的“基础准入证”,精准检测这两类突变,可先将约50%的耐药患者排除在外,为后续治疗精准“铺路”。而新兴靶点和液体活检技术有望进一步优化诊疗策略。未来,随着人工智能和数字病理学的发展,CRC的分子分类将更加精准和高效,从而改善患者预后并推动精准医疗的进步。
第二级:
技术落地——从实验室到病床,日本精准医疗的实践启示
日本结直肠癌精准医疗的现状2
研究概述
CRC作为日本乃至全球范围内的高发恶性肿瘤,其精准诊疗的发展对于改善患者预后具有重要意义。本文全面梳理了日本CRC精准医学的最新进展,重点关注关键生物标志物的临床应用、分子诊断技术的革新以及国家层面的精准医疗体系建设。研究详细阐述了RAS、BRAF V600E、MSI/MMR状态和HER2扩增等核心生物标志物在治疗决策中的作用机制和临床价值,同时深入分析了全面基因组分析(CGP)和液体活检技术(如ctDNA检测)在日本临床实践中的应用现状、国家层面举措及面临的挑战,为优化临床实践提供参考。
研究结果
生物标志物检测方面:日本将RAS(exon 2/3/4)、BRAF V600E、MSI/dMMR 等检测纳入医保,已建立起较为完善的检测体系。MEBGEN RASKET -B等已获批检测试剂盒可准确识别RAS突变状态,为抗EGFR治疗提供关键决策依据。研究发现,RAS突变患者对抗EGFR治疗普遍耐药,而KRAS G12C突变亚群对单药KRAS抑制剂响应有限,联合EGFR抑制剂(如adagrasib+西妥昔单抗)疗效更优(FDA已获批,日本尚未获批)。BRAF V600E突变检测则成为预后评估的重要指标,这类患者往往预后较差,但可从BRAF抑制剂联合治疗方案中获得生存获益(日本获批二线治疗)。值得注意的是,MSI-H/dMMR患者对免疫治疗表现出显著响应,这使其成为免疫检查点抑制剂治疗的优势人群。
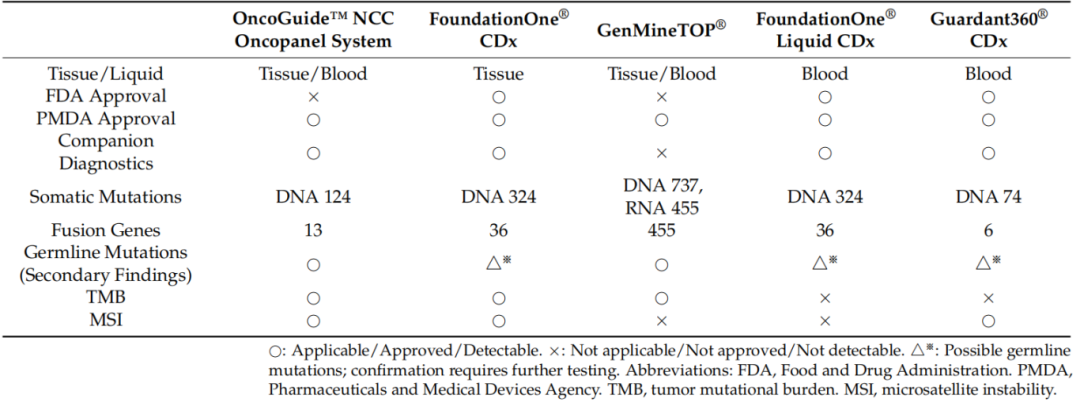
表. 日本已获批的NGS检测套餐
技术创新方面:液体活检技术展现出巨大潜力。CIRCULATE-Japan GALAXY研究证实,ctDNA检测可较传统影像学提前数月预测肿瘤复发。液体活检的另一核心价值是动态监测——部分初始RAS突变患者在治疗后,ctDNA 中RAS突变消失(即“Neo-RAS野生型”),这类患者重启抗EGFR治疗的ORR可达30%,证实精准检测能“实时追踪”肿瘤变化,最大化治疗机会。DNA甲基化检测则能有效预测抗EGFR治疗的敏感性,高甲基化患者的治疗有效率仅为4.2%,显著低于低甲基化患者的33.3%。然而,这些创新技术目前尚未纳入日本医保体系,限制了其临床应用。日本特有的精准医疗体系也面临挑战,如CGP检测的平均周转时间长达4周以上,凸显出精准医疗落地实施的现实困境。
研究结论
得益于有医保覆盖的“硬性支撑”,日本在CRC精准医学领域已建立起国际领先的技术体系和医疗网络,但仍需解决技术推广和医疗资源分配不均等问题。未来应加速创新疗法(如KRAS G12C抑制剂和HER2靶向药物)的审批,扩大液体活检等技术的医疗保险覆盖,并整合真实世界数据以优化治疗策略。通过加强分子肿瘤委员会的标准化和提升基因组医学的普及性,日本有望进一步推动CRC精准诊疗的发展,改善患者预后。这一发展路径也为其他国家的精准医疗实践提供了有价值的参考。
第三级:
前沿突破——亚克隆突变,抗EGFR治疗的“漏网之鱼”被捕获
晚期或转移性结直肠癌患者液体活检中亚克隆RAS/BRAF改变的临床影响3
研究概述
RAS(KRAS/NRAS)和BRAF突变是mCRC患者对EGFR抑制剂(如西妥昔单抗、帕尼单抗)耐药的关键生物标志物,目前临床指南将RAS/BRAF突变患者排除在抗EGFR治疗之外。然而,肿瘤存在克隆异质性,亚克隆(突变比例低)RAS/BRAF改变的临床意义尚不明确。本研究通过液体活检(如ctDNA)数据,探讨亚克隆RAS/BRAF突变患者接受抗EGFR治疗的疗效,旨在为这类患者的治疗决策提供依据。
研究结果
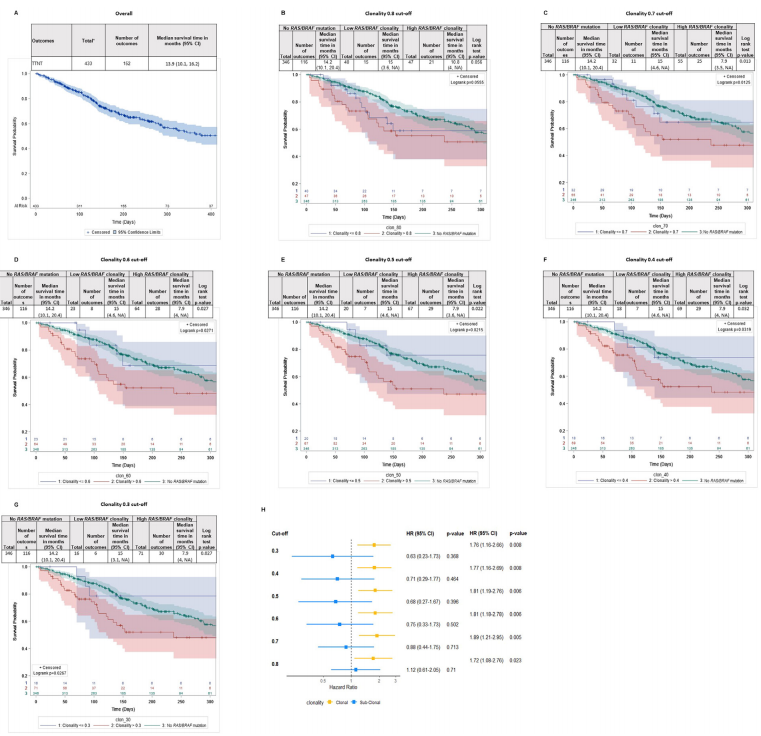
突变分布:446例患者中,11%(50例)存在BRAF V600E突变,9%(38例)存在KRAS突变,1%(4例)存在NRAS突变;RAS/BRAF克隆性中位数为0.84(IQR 0.57-1.00)。
疗效对比:亚克隆RAS/BRAF突变患者(克隆性阈值0.3-0.8)的至下次治疗时间(TTNT)与野生型患者相似(中位数15.0个月 vs. 14.2个月),而克隆性突变患者的TTNT显著缩短(7.9个月)。OS方面,亚克隆突变患者的生存期(19.1个月)虽低于野生型组(34.7个月),但显著优于克隆突变组(15.6个月)。
敏感性分析:采用60天或120天的治疗-检测时间窗口,结果与90天窗口一致,进一步支持了结果的稳健性。
亚组分析:左半结肠癌患者的TTNT(20.3个月)和OS(53.7个月)显著优于右半结肠癌患者(TTNT 7.9个月,OS 20.8个月);随着治疗线数增加,亚克隆突变比例上升,提示肿瘤进化可能导致亚克隆比例随治疗线数增加。
图. 在经Guardant360检测后90天内启动抗EGFR治疗的转移性结直肠癌患者中,绘制Kaplan–Meier曲线以评估TTNT
(A)为总体人群;随后按突变丰度分为三组(无RAS/RAF突变、低RAS/RAF克隆度、高RAS/RAF克隆度),并以不同克隆度阈值展示;(B)0.8;(C)0.7;(D)0.6;(E)0.5;(F)0.4;(G)0.3;(H)为不同克隆度截点的调整后HR森林图,用于比较各组TTNT差异
研究结论
本研究基于大样本真实世界数据证实,亚克隆RAS/BRAF突变的晚期结直肠癌患者可从抗EGFR治疗中获益,为重新定义抗EGFR治疗的适用人群提供了关键证据。这一发现与既往基于组织活检的研究一致,支持在临床实践中通过高灵敏度检测技术(如NGS)识别亚克隆突变群体,以扩大抗EGFR治疗的适用人群。未来需开展前瞻性研究以验证克隆性阈值标准,并探索抗EGFR治疗再挑战的最佳时机。这一成果为mCRC的精准治疗提供了新思路,强调了肿瘤克隆异质性在治疗决策中的重要性。
结语
从核心突变的基础筛选,到日本模式的临床落地,再到亚克隆突变的突破性发现,结直肠癌精准检测正在实现“三级跳”:其核心价值不仅是排除耐药患者,更在于为每一位患者找到最适合的治疗。未来,随着液体活检灵敏度的提升和多组学整合(基因组+表观遗传),抗EGFR治疗的“精准度”将进一步提高,让更多患者跨过“突变”的门槛,获得生存希望。
编辑林颖整理股利网
翔云优配官网提示:文章来自网络,不代表本站观点。